Test immunoenzymatyczny ELISPOT: Perspektywy zastosowań w alergologii i immunologii
Radosław Śpiewak
Źródło: Śpiewak R. Test immunoenzymatyczny ELISPOT: Perspektywy zastosowań w alergologii i immunologii. Alergol Immunol 2007; 4 (3-4): 77-81.
|
Streszczenie: ELISPOT (Enzyme-Linked ImmunoSpot Assay, synonimy: Immunospot, ELISA Spot, ELISA-plaque) staje się coraz bardziej uznanym narzędziem w nowoczesnej medycynie. Technika ma już ugruntowaną pozycję w takich dziedzinach jak biotechnologia (produkcja i selekcja przeciwciał), wakcynologia (produkcja i testowanie szczepionek), immunologia (badania naukowe i diagnostyka), choroby zakaźne (testy diagnostyczne o podwyższonej czułości), czy wreszcie onkologia (rozwój immunoterapii i testy leków przeciwnowotworowych). Coraz częściej ELISPOT stosowany jest również w alergologii doświadczalnej i klinicznej. ELISPOT, podobnie jak ELISA, opiera się na stosowaniu par przeciwciał wiążących oraz detekcyjnych. Są jednak istotne różnice, np. wiązanie przeciwciał z fazą stałą odbywa się w trakcie hodowli komórkowej. Dzięki temu ELISPOT przezwycięża szereg problemów metodycznych techniki ELISA oraz zapewnia wysoką czułość. Wśród 1 000 000 komórek można wykryć pojedynczą komórkę wydzielającą dane białko (cytokinę, białko efektorowe, receptor, marker powierzchniowy lub przeciwciało). ELISPOT nie jest wrażliwy na zachodzącą w hodowli konsumpcję badanej cytokiny (jest to istotne np. przy oznaczaniu IL-4 lub IL-2). Dual ELISPOT jest rozwinięciem techniki, umożliwiającym śledzenie wydzielania różnych białek przez tę samą komórkę. Dzięki połączeniu metod ELISPOT i ELISA można ponadto szacować średnią produkcję cytokin przez pobudzone komórki. Ponieważ ELISPOT jest jeszcze słabo rozpowszechniony w naszym kraju, celem niniejszego artykułu jest przybliżenie czytelnikom tej obiecującej metody z jej możliwościami i ograniczeniami, a także przegląd potencjalnych zastosowań ELISPOTu w badaniach podstawowych oraz klinicznych z zakresu alergologii i immunologii.
Słowa kluczowe: techniki laboratoryjne, techniki immunoenzymatyczne, ELISPOT, ELISA, immunologia, alergologia, onkologia, wakcynologia.
|
Abstract
Reprint (PDF)
Linki:
Sensimun - badania biomedyczne na zlecenie
dermatolog, wenerolog i alergologm, Kraków
|
Techniki immunoenzymatyczne to techniki laboratoryjne wykorzystujące łącznie 2 rodzaje reakcji: 1) reakcję immunologiczną (antygen-przeciwciało) w detekcji interesującej badacza cząsteczki oraz 2) reakcję enzymatyczną (przekształcenie chromogenu w barwnik znacznikowy) w pomiarze jakościowym (wizualizacja) lub ilościowym badanego białka. W technikach immunoenzymatycznych wnioski na temat obecności i/lub stężenia badanej substancji wyciąga się pośrednio, na podstawie obecności i/lub stężenia znacznika (barwnik powstały w wyniku enzymatycznej przemiany substancji barwnej, czyli chromogenu). Technika ELISPOT (Enzyme-Linked ImmunoSPOT assay, synonimy: Immunospot, ELISA Spot, ELISA-plaque) jest twórczym rozwinięciem enzymatycznego testu immunosorpcyjnego ELISA i jednocześnie połączeniem testu immunoenzymatycznego z hodowlą komórkową. Test ten opracował w roku 1983 Cecil Czerkinsky - francuski badacz pracujący w Szwecji i niezależnie od niego australijski naukowiec Jonathon D. Sedgwick (Tabela 1).
Tabela 1. ELISPOT - chronologia zastosowań
| 1982 |
Cecil Czerkinsky i wsp. (1) |
Pierwszy opis zastosowania ELISPOTu do wykrywania komórek bakteryjnych wydzielających enterotoksynę |
| 1983 |
Jonathon D. Sedgwick i Patrick G. Holt (2)
|
Zastosowanie ELISPOTu (autorzy używali nazwy ELISA-plaque) do wykrywania komórek (plazmocytów) szczurzych wydzielających przeciwciała swoiste wobec albuminy jaja kurzego |
| 1983 |
Cecil Czerkinsky i wsp. (3) |
Zastosowania ELISPOTu do wykrywania komórek (plazmocytów) mysich wydzielających przeciwciała swoiste wobec albuminy jaja kurzego |
| 1988 |
Cecil Czerkinsky i wsp. (4) |
Zastosowanie ELISPOTu do wykrywania komórek wydzielających IFN-γ |
| 1988 |
Cecil Czerkinsky i wsp. (5) |
Dual-ELISPOT - system dwubarwny do jednoczesnej detekcji wydzielania dwóch różnych cytokin w jednej hodowli komórkowej (a także z jednej komórki) |
| 1997 |
Yan Cui i Lung-Ji Chang (6) |
Wprowadzenie komputerowej analizy obrazu w celu przyspieszenia i obiektywizacji oceny wyników |
| 2002 |
Radosław Śpiewak (7) |
Pierwsze w Polsce zastosowanie ELISPOTu: detekcja swoistej odpowiedzi komórek jednojądrzastych krwi na antygeny bakterii powietrznopochodnych |
ELISPOT - test immunoenzymatyczny przyszłości
ELISPOT staje się coraz bardziej uznanym narzędziem w nowoczesnym laboratorium naukowym, co znajduje odzwierciedlenie w lawinowo rosnącej liczbie badań z jego zastosowaniem (ryc. 1). Test ten ma już ugruntowaną pozycję w wakcynologii, gdzie stosowany jest między innymi w produkcji i testowaniu skuteczności szczepionek przeciw HIV (8-16), wirusowemu zapaleniu wątroby (17), cholerze (18,19), półpaścowi (20), grypie (21,22) czy malarii (23). Test ELISPOT w kierunku komórek specyficznie reagujących na antygen prątka gruźlicy znalazł już rutynowe zastosowanie kliniczne i cechuje się większą czułością i swoistością w porównaniu do innych dostępnych testów na gruźlicę (24-33). Technika ELISPOT jest również wykorzystywana w pracach nad skuteczniejszymi szczepionkami przeciwgruźliczymi (34). Obiecujące są zastosowania testu ELISPOT w wykrywaniu swoistej odpowiedzi immunologicznej na antygeny krętka Borrelia burgdorferi (35,36), krętka bladego (Treponema pallidum) (37) oraz salmonelli (38). Test ELISPOT stał się niezastąpionym narzędziem w immunologii onkologicznej, gdzie m. in. wyparł radioaktywny test uwalniania chromu w ocenie funkcji komórek cytotoksycznych (39,40). Jest on również szeroko stosowany w badaniach nad szczepionkami przeciwnowotworowymi (41-43). ELISPOT znajduje ponadto zastosowanie w badaniach naukowych i diagnostyce reumatologicznej, a także w testowaniu leków przeciwreumatycznych (44-55). W diabetologii wykorzystuje się ELISPOT w wykrywaniu komórek cytotoksycznych skierowanych przeciw wyspom trzustkowym (56).
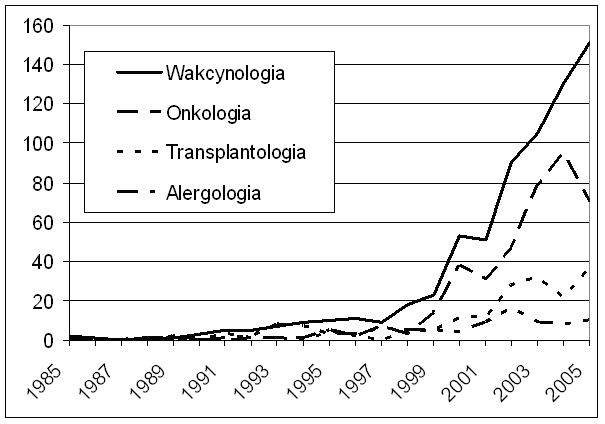
|
Ryc. 1. Liczba publikacji opartych na technice ELISPOT (analiza własna danych z Medline) |
Z pewnym opóźnieniem, jednak coraz szerzej ELISPOT wkracza również do alergologii doświadczalnej i klinicznej. Test ten stosowano z powodzeniem w detekcji zaburzeń równowagi immunologicznej oraz swoistej odpowiedzi immunologicznej w skazie atopowej (57,58) oraz wyprysku atopowym (59). Za pomocą testu ELISA wykrywa się swoiste limfocyty w alergii pokarmowej (60,61). Technika ta jest również przydatna w ocenie przestrojenia immunologicznego w przebiegu immunoterapii i farmakoterapii chorych uczulonych na jady owadów (62), oraz w wykrywaniu swoistych limfocytów w alergicznym zapaleniu pęcherzyków płucnych (63), a także w alergii lekowej (64).
Obszarem najintensywniej bodaj eksplorowanym w alergologii za pomocą testu ELISPOT jest alergia kontaktowa i alergiczne kontaktowe zapalenie skóry. Jak się wydaje, wynika to głównie z dwóch cech tego testu: jego wysokiej czułości i niewrażliwości na konsumpcję wydzielanych cytokin przez komórki w hodowli. ELISPOT, podobnie jak tradycyjna ELISA opiera się na stosowaniu par przeciwciał wiążących oraz detekcyjnych. Są jednak istotne różnice, zestawione w Tabeli 2. Należy pamiętać, że przeciwciała stosowane w metodzie ELISA nie zawsze nadają się do ELISPOTu. Zalecane jest stosowanie par przeciwciał przygotowanych specjalnie dla tej metody (większość producentów, m.in. firmy Mabtech i Sanquin mają takie pary w swojej ofercie). Substraty barwne (chromogeny) do testu ELISA są rozpuszczalne w wodzie i nie sprawdzą się podczas wykonywania ELISPOTu, w którym potrzebne są chromogeny nierozpuszczalne. ELISPOT przezwycięża szereg problemów metodycznych techniki ELISA oraz zapewnia wysoką czułość. Ta wysoka czułość testu ELISPOT pozwala wykryć pojedynczą komórkę wydzielającą dane białko (cytokinę, białko efektorowe, receptor, marker powierzchniowy lub przeciwciało) wśród 1 000 000 komórek w hodowli (66). Umożliwia to wykrywanie w krwi obwodowej pojedynczych limfocytów pamięci, swoistych wobec danej substancji uczulającej (67). Natychmiastowe i nieodwracalne związanie cytokiny wydzielonej przez komórkę z fazą stałą zapobiega zużyciu tej cytokiny przez komórki w dalszym przebiegu hodowli, co jest bardzo dużym problemem np. przy oznaczaniu cytokin (np. IL-4 lub IL-2) za pomocą tradycyjnego testu ELISA (68). Kolejną zaletą jest możliwość śledzenia wydzielania różnych białek przez tę samą komórkę za pomocą techniki Dual ELISPOT (5, 55). Dzięki wymienionym zaletom testu ELISPOT możliwe było dokonanie istotnego postępu. To właśnie za pomocą tej techniki udało się badaczom wykazać, że w patomechanizmie alergii kontaktowej i alergicznego kontaktowego zapalenia skóry kluczową rolę odgrywają limfocyty wydzielające IL-4, IL-5 i IL-13, co stanowi przełom w naszym rozumieniu mechanizmów tych zaburzeń (69-79).
Tabela 2. ELISPOT i ELISA: podobieństwa i różnice (65)
| Porównywana cecha |
ELISA |
ELISPOT |
| Wynik badania: |
Stężenie danej cytokiny wydzielonej przez wszystkie komórki w hodowli (np. pg/ml nadsączu) |
Liczba komórek wydzielających daną cytokinę (np. n/1 mln komórek) |
| Ryzyko zafałszowania wyniku na skutek konsumpcji analizowanego białka przez komórki w hodowli: |
Tak |
Nie |
| Zasada detekcji białka: |
Reakcja immunoenzymatyczna |
Reakcja immunoenzymatyczna |
| Przeciwciała pierwotne: |
Opłaszczane w dodatkowej płytce sorbcyjnej po zakończeniu hodowli |
Opłaszczane w płytce hodowlanej przed rozpoczęciem hodowli |
| Przeciwciała wtórne: |
Dodawane do dodatkowej płytki sorbcyjnej po zakończeniu hodowli |
Dodawane do płytki hodowlanej po zakończeniu hodowli |
| Reakcja barwna: |
Fosfataza zasadowa (ALP) + substrat barwny lub peroksydaza chrzanowa (HRP) + substrat barwny |
Fosfataza zasadowa (ALP) + substrat barwny lub peroksydaza chrzanowa (HRP) + substrat barwny |
| Wykonanie detekcji i reakcji barwnej: |
W nadsączu z hodowli w osobnej płytce sorbcyjnej |
Bezpośrednio w płytce hodowlanej |
| Sposób zatrzymania reakcji barwnej: |
Zmiana pH (np. dodanie H2SO4) w fazie płynnej |
Wypłukanie wodą i wysuszenie płytki |
| Faza ostatecznego pomiaru: |
Faza płynna |
Faza sucha |
| Urządzenie pomiarowe: |
Czytnika ELISA (spektrofotometr) |
Czytnika ELISPOTu (kamera + program do analizy obrazu) |
| Uzyskanie wyniku ilościowego: |
Pomiar ekstynkcji w reakcji barwnej i wyliczenie stężenia z krzywej kalibracyjnej |
Komputerowa analiza obrazu (1 plamka = 1 komórka) |
| Możliwość przesyłania płytki do analizy poza laboratorium: |
Nie |
Tak |
| Okres, w którym jest możliwa powtórna analiza: |
15-30 minut |
Tygodnie - miesiące |
Jak działa ELISPOT
Jak już wspomniano, ELISPOT jest połączeniem techniki immunoenzymatycznej fazy stałej z krótkoterminową hodowlą komórkową (od kilku godzin do kilku dni). Kolejne etapy wykonania testu zostały przedstawione na ryc. 2.
- Komórki inkubuje się w płytkach ELISPOT. Dno każdego dołka płytki zostało uprzednio opłaszczone przeciwciałami wiążącymi (syn. przeciwciała pierwotne, opłaszczające). Przeciwciała te są swoiste wobec interesującego nas białka, np. określonej cytokiny, przeciwciała, markera błonowego, receptora itd. Jeżeli w trakcie hodowli komórka wydzieli interesujące nas białko, to zostanie ono związane z dnem dołka przez przeciwciało wiążące. Wiązanie takie jest swoiste, dlatego do membrany przyczepiają się tylko interesujące nas cząsteczki.
- Po zakończeniu hodowli, usuwamy komórki z dołków, a płytkę dokładnie i wielokrotnie płuczemy. Na dnie dołka pozostaje jedynie badane białko związane przeciwciałem pierwotnym. Dodajemy znakowane biotyną przeciwciało wtórne (syn. detekcyjne), które wiąże się z innym epitopem badanego białka.
- Następnie dodajemy sprzężony ze streptawidyną enzym, np. fosfatazę alkaliczną - ALP lub peroksydazę chrzanową - HRP. Streptawidyna silnie wiąże się z biotyną znakującą przeciwciało wtórne (detekcyjne). Dokładne płukanie płytki usuwa nadmiar enzymu.
- Dodajemy substraty barwne (chromogeny), które w obecności enzymu przekształcą się w barwnik. Na przykład w przypadku znakowania fosfatazą zasadową (ALP), dodaje się roztwór BCIP i NBT (5-bromo-4-chloro-3-indolyl phosphate + nitro blue tetrazolium). W wyniku reakcji zachodzącej pod wpływem enzymu powstaje barwnik, który osadza się na dnie dołka.
- Reakcję barwną zatrzymujemy przez dokładne wypłukanie i wysuszenie płytki.
- W miejscu reakcji immunoenzymatycznej powstaje plamka barwna - "spot" (Ryc. 3). Przyjmuje się, ze każdy spot jest śladem jednej komórki wydzielającej badane białko. W przypadku komórek szybko dzielących się, mówimy o "jednostkach tworzących spot" (spot forming units - SFU).
Ostatnim etapem jest liczenie spotów. Dawniej pracę tę wykonywano "na piechotę", czyli pod mikroskopem, co znacznie zwiększało nakład pracy a tym samym ograniczało zastosowanie metody. Obecnie liczenie plamek barwnych wykonuje się automatyczne za pomocą specjalnego skanera z systemem analizy obrazu.
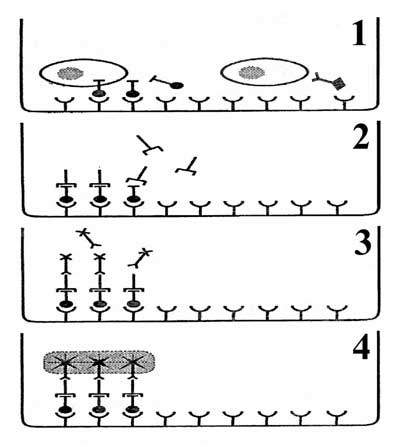
|
Ryc. 2. Zasada testu ELISPOT - objaśnienia w tekście (7) |
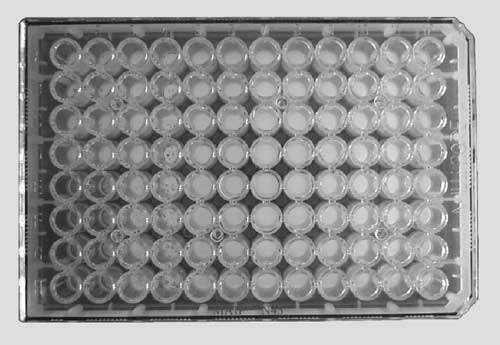
|
Ryc. 3. Płytka ELISPOT po zakończeniu hodowli i wykonaniu reakcji barwnej. Każda plamka ("spot") widoczny np. we wszystkich dołkach w 4-ej kolumny reprezentuje jedną antygenowo-swoistą komórkę (7) |
Podsumowując, ELISPOT jest rozwinięciem i pod wieloma względami udoskonaleniem techniki ELISA. Jego zalety zostały już docenione przez badaczy w wielu dziedzinach medycyny, co opisano powyżej. Aktualnie obserwujemy przełom w rozumieniu patomechanizmu alergii kontaktowej i alergicznego kontaktowego zapalenia skóry, który dokonał się głównie dzięki omówionym zaletom testu ELISPOT. Kontynuacją opisanych wcześnie obserwacji są obiecujące próby wdrożenia ELISPOTu do diagnostyki laboratoryjnej alergicznego kontaktowego zapalenia skóry, w czym bierze udział również nasz zespół (74, 75, 76, 77, 80, 81, 82, 83, 84).
Piśmiennictwo
- Czerkinsky CC, Svennerholm AM. Ganglioside GM1 enzyme-linked immunospot assay for simple identification of heat-labile enterotoxin-producing Escherichia coli. J Clin Microbiol 1983;17:965-9.
- Sedgwick JD, Holt PG. A solid-phase immunoenzymatic technique for the enumeration of specific antibody-secreting cells. J Immunol Methods 1983;57:301-9.
- Czerkinsky CC, Nilsson LA, Nygren H, Ouchterlony O, Tarkowski A. A solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of specific antibody-secreting cells. J Immunol Methods 1983;65:109-21.
- Czerkinsky C, Andersson G, Ekre HP, Nilsson LA, Klareskog L, Ouchterlony O. Reverse ELISPOT assay for clonal analysis of cytokine production. I. Enumeration of gamma-interferon-secreting cells. J Immunol Methods 1988;110:29-36.
- Czerkinsky C, Moldoveanu Z, Mestecky J, Nilsson LA, Ouchterlony O. A novel two colour ELISPOT assay. I. Simultaneous detection of distinct types of antibody-secreting cells. J Immunol Methods 1988;115:31-7.
- Cui Y, Chang LJ. Computer-assisted, quantitative cytokine enzyme-linked immunospot analysis of human immune effector cell function. Biotechniques 1997;22:1146-9.
- Śpiewak R. Dermatozy zawodowe w rolnictwie: epidemiologia, etiopatogeneza, czynniki ryzyka. Wydawnictwo Czelej, Lublin 2002, 85-96.
- Ewer K, Deeks J, Alvarez L, Bryant G, Waller S, Andersen P, Monk P, Lalvani A. Comparison of T-cell-based assay with tuberculin skin test for diagnosis of Mycobacterium tuberculosis infection in a school tuberculosis outbreak. Lancet 2003;361:1168-73.
- De Groot AS, Bishop EA, Khan B, Lally M, Marcon L, Franco J, Mayer KH, Carpenter CC, Martin W. Engineering immunogenic consensus T helper epitopes for a cross-clade HIV vaccine. Methods 2004;34: 476-87
- Eriksson K, Kilander A, Hagberg L, Norkrans G, Holmgren J, Czerkinsky C. Intestinal antibody responses to oral vaccination in HIV-infected individuals. AIDS 1993;7:1087-91.
- Moodie Z, Huang Y, Gu L, Hural J, Self SG. Statistical positivity criteria for the analysis of ELISpot assay data in HIV-1 vaccine trials. J Immunol Methods 2006;315:121-32.
- Periwal SB, Spagna K, Shahabi V, Quiroz J, Shroff KE. Statistical evaluation for detection of peptide specific interferon-gamma secreting T-cells induced by HIV vaccine determined by ELISPOT assay. J Immunol Methods 2005;305:128-34.
- Cox JH, Ferrari G, Kalams SA, Lopaczynski W, Oden N, D'souza MP. Results of an ELISPOT proficiency panel conducted in 11 laboratories participating in international human immunodeficiency virus type 1 vaccine trials. AIDS Res Hum Retroviruses 2005;21:68-81.
- Hudgens MG, Self SG, Chiu YL, Russell ND, Horton H, McElrath MJ. Statistical considerations for the design and analysis of the ELISpot assay in HIV-1 vaccine trials. J Immunol Methods 2004;288:19-34.
- Novitsky V, Rybak N, McLane MF, Gilbert P, Chigwedere P, Klein I, Gaolekwe S, Chang SY, Peter T, Thior I. Identification of human immunodeficiency virus type 1 subtype C Gag-, Tat-, Rev-, and Nef-specific elispot-based cytotoxic T-lymphocyte responses for AIDS vaccine design. J Virol. 2001;75:9210-28.
- Mwau M, McMichael AJ, Hanke T. Design and validation of an enzyme-linked immunospot assay for use in clinical trials of candidate HIV vaccines. AIDS Res Hum Retroviruses 2002;18:611-8.
- Shokrgozar MA, Sam MR, Amirkhani A, Shokri F. Frequency analysis of HBsAg-specific B lymphocytes in high-responder individuals to recombinant hepatitis B vaccine: comparison of LDA and ELISPOT assays. Scand J Immunol 2006;64:536-43.
- Friman V, Quiding M, Czerkinsky C, Nordstrom I, Larsson L, Ericson D, Bjorkander J, Theman K, Kilander A, Holmgren J. Intestinal and circulating antibody-forming cells in IgA-deficient individuals after oral cholera vaccination. Clin Exp Immunol 1994;95:222-6
- Quiding M, Nordstrom I, Kilander A, Andersson G, Hanson LA, Holmgren J, Czerkinsky C. Intestinal immune responses in humans. Oral cholera vaccination induces strong intestinal antibody responses and interferon-gamma production and evokes local immunological memory. J Clin Invest 1991;88:143-8.
- Smith JG, Liu X, Kaufhold RM, Clair J, Caulfield MJ. Development and validation of a gamma interferon ELISPOT assay for quantitation of cellular immune responses to varicella-zoster virus. Clin Diagn Lab Immunol 2001;8:871-9.
- Dercamp C, Sanchez V, Barrier J, Trannoy E, Guy B. Depletion of human NK and CD8 cells prior to in vitro H1N1 flu vaccine stimulation increases the number of gamma interferon-secreting cells compared to the initial undepleted population in an ELISPOT assay. Clin Diagn Lab Immunol 2002;9:230-5.
- Currier JR, Kuta EG, Turk E, Earhart LB, Loomis-Price L, Janetzki S, Ferrari G, Birx DL, Cox JH. A panel of MHC class I restricted viral peptides for use as a quality control for vaccine trial ELISPOT assays. J Immunol Methods 2002;260:157-72.
- Qian F, Zhang QF, Shen LH, Pan WQ. [CTL response to pre-erythrocytic stage vaccine candidate of plasmodium falciparum in HLA-A*0201 transgenic mice detected by ELISPOT assay]. Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi 2006;24:319-20
- Lawn SD, Bangani N, Vogt M, Bekker LG, Badri M, Ntobongwana M, Dockrell HM, Wilkinson RJ, Wood R. Utility of interferon-gamma ELISPOT assay responses in highly tuberculosis-exposed patients with advanced HIV infection in South Africa. BMC Infect Dis 2007;7:99.
- Clayton R, Grabczynska S, Wilkinson JD. Nodular vasculitis: an indicator for ELISpot screening for tuberculosis? Clin Exp Dermatol 2007;32:761-2.
- Hill PC, Brookes RH, Fox A, Jackson-Sillah D, Jeffries DJ, Lugos MD, Donkor SA, Adetifa IM, de Jong BC, Aiken AM. Longitudinal assessment of an ELISPOT test for Mycobacterium tuberculosis infection. PLoS Med 2007;4:e192.
- Adetifa IM, Brookes R, Lugos MD, de Jong BC, Antonio M, Adegbola RA, Hill PC. Rising ELISPOT count prior to the onset of symptoms of full-blown tuberculosis disease. Int J Tuberc.Lung Dis 2007;11:350-2.
- Hill PC, Jeffries DJ, Brookes RH, Fox A, Jackson-Sillah D, Lugos MD, Donkor SA, de Jong BC, Corrah T, Adegbola RA. Using ELISPOT to expose false positive skin test conversion in tuberculosis contacts. PLoS ONE 2007;2:e183.
- Mantegani P, Piana F, Codecasa L, Galli L, Scarpellini P, Lazzarin A, Cirillo D, Fortis C. Comparison of an in-house and a commercial RD1-based ELISPOT-IFN-gamma assay for the diagnosis of Mycobacterium tuberculosis infection. Clin Med Res 2006; 4:266-72.
- Aiken AM, Hill PC, Fox A, McAdam KP, Jackson-Sillah D, Lugos MD, Donkor SA, Adegbola RA, Brookes RH. Reversion of the ELISPOT test after treatment in Gambian tuberculosis cases. BMC Infect.Dis 2006;6:66.
- Jeffries DJ, Hill PC, Fox A, Lugos M, Jackson-Sillah DJ, Adegbola RA, Brookes RH. Identifying ELISPOT and skin test cut-offs for diagnosis of Mycobacterium tuberculosis infection in The Gambia. Int J Tuberc.Lung Dis 2006;10:192-8.
- Lazarevic V, Pawar S, Flynn J. Measuring T-cell function in animal models of tuberculosis by ELISPOT. Methods Mol Biol 2005;302:179-90.
- Doherty TM, Demissie A, Menzies D, Andersen P, Rook G, Zumla A. Effect of sample handling on analysis of cytokine responses to Mycobacterium tuberculosis in clinical samples using ELISA, ELISPOT and quantitative PCR. J Immunol Methods 2005;298:129-41.
- McMurry JA, Kimball S, Lee JH, Rivera D, Martin W, Weiner DB, Kutzler M, Sherman DR, Kornfeld H, De Groot AS. Epitope-driven TB vaccine development: a streamlined approach using immuno-informatics, ELISpot assays, and HLA transgenic mice. Curr Mol Med 2007;7:351-68.
- Ekerfelt C, Masreliez C, Svenvik M, Ernerudh J, Roberg M, Forsberg P. Antibodies and T-cell reactivity to Borrelia burgdorferi in an asymptomatic population: a study of healthy blood donors in an inland town district in the south-east of Sweden. Scand J Infect Dis 2001;33:806-8.
- Ekerfelt C, Ernerudh J, Bunikis J, Vrethem M, Aagesen J, Roberg M, Bergstrom S, Forsberg P. Compartmentalization of antigen specific cytokine responses to the central nervous system in CNS borreliosis: secretion of IFN-gamma predominates over IL-4 secretion in response to outer surface proteins of Lyme disease Borrelia spirochetes. J Neuroimmunol 1997;79:155-62.
- Tabidze IL, Lee FK, Tambe P, Rocha E, Larsen SA, Stoll BJ, Louis MES, Nahmias AJ. Enzyme-linked immunospot assay for the diagnosis of active Treponema pallidum infection during the various stages of syphilis. Sex Transm Dis 1999;26:426-30.
- VanCott JL, Staats HF, Pascual DW, Roberts M, Chatfield SN, Yamamoto M, Coste M, Carter PB, Kiyono H, McGhee JR. Regulation of mucosal and systemic antibody responses by T helper cell subsets, macrophages, and derived cytokines following oral immunization with live recombinant Salmonella. J Immunol 1996;156:1504-14.
- Scheibenbogen C, Romero P, Rivoltini L, Herr W, Schmittel A, Cerottini JC, Woelfel T, Eggermont AM, Keilholz U. Quantitation of antigen-reactive T cells in peripheral blood by IFNgamma-ELISPOT assay and chromium-release assay: a four-centre comparative trial. J Immunol Methods 2000;244:81-9.
- Jonuleit H, Giesecke A, Kandemir A, Paragnik L, Knop J, Enk AH. Induction of tumor peptide-specific cytotoxic T cells under serum-free conditions by mature human dendritic cells. Arch Dermatol Res 2000;292:325-32.
- Janetzki S, Panageas KS, Ben-Porat L, Boyer J, Britten CM, Clay TM, Kalos M, Maecker HT, Romero P, Yuan J. Results and harmonization guidelines from two large-scale international Elispot proficiency panels conducted by the Cancer Vaccine Consortium (CVC/SVI). Cancer Immunol Immunother. 2007 August 25.
- Shafer-Weaver K, Rosenberg S, Strobl S, Gregory AW, Baseler M, Malyguine A. Application of the granzyme B ELISPOT assay for monitoring cancer vaccine trials. J Immunother (1997) 2006 ;29:328-35.
- Tarkowski A, Czerkinsky C, Nilsson LA. Simultaneous induction of rheumatoid factor- and antigen-specific antibody-secreting cells during the secondary immune response in man. Clin Exp Immunol 1985;61:379-87.
- Tarkowski A, Czerkinsky C, Nilsson LA, Nygren H, Ouchterlony O. Solid-phase enzyme-linked immunospot (ELISPOT) assay for enumeration of IgG rheumatoid factor-secreting cells. J Immunol Methods 1984;72:451-9.
- Pass HA, Schwarz SL, Wunderlich JR, Rosenberg SA. Immunization of patients with melanoma peptide vaccines: immunologic assessment using the ELISPOT assay. Cancer J Sci Am 1998;4:316-23.
- Frauendorf E, von GH, May E, Marker-Hermann E. HLA-B27-restricted T cells from patients with ankylosing spondylitis recognize peptides from B*2705 that are similar to bacteria-derived peptides. Clin Exp Immunol 2003;134:351-9.
- Willeke P, Schotte H, Schluter B, Erren M, Becker H, Dyong A, Mickholz E, Domschke W, Gaubitz M. Interleukin 1beta and tumour necrosis factor alpha secreting cells are increased in the peripheral blood of patients with primary Sjogren's syndrome. Ann Rheum Dis 2003;62:359-62.
- Fiorillo MT, Maragno M, Butler R, Dupuis ML, Sorrentino R. CD8(+) T-cell autoreactivity to an HLA-B27-restricted self-epitope correlates with ankylosing spondylitis. J Clin Invest 2000;106:47-53.
- Hohler T, Hug R, Schneider PM, Krummenauer F, Gripenberg-Lerche C, Granfors K, Marker-Hermann E. Ankylosing spondylitis in monozygotic twins: studies on immunological parameters. Ann Rheum Dis 1999;58:435-40.
- Halse A, Wahren-Herlenius M, Jonsson R. Ro/SS-A- and La/SS-B-reactive B lymphocytes in peripheral blood of patients with Sjogren's syndrome. Clin Exp Immunol 1999;115:208-13.
- Halse A, Harley JB, Kroneld U, Jonsson R. Ro/SS-A-reactive B lymphocytes in salivary glands and peripheral blood of patients with Sjogren's syndrome. Clin Exp Immunol 1999;115:203-7.
- Ronnelid J, Berg L, Rogberg S, Nilsson A, Albertsson K, Klareskog L. Production of T-cell cytokines at the single-cell level in patients with inflammatory arthritides: enhanced activity in synovial fluid compared to blood. Br J Rheumatol. 1998;37:7-14.
- Feltelius N, Gudmundsson S, Wennersten L, Sjoberg O, Hallgren R, Klareskog L. Enumeration of IgA producing cells by the enzyme linked immunospot (ELISPOT) technique to evaluate sulphasalazine effects in inflammatory arthritides. Ann Rheum.Dis. 1991;50:369-71.
- Schotte H, Schluter B, Willeke P, Mickholz E, Schorat MA, Domschke W, Gaubitz M. Long-term treatment with etanercept significantly reduces the number of proinflammatory cytokine-secreting peripheral blood mononuclear cells in patients with rheumatoid arthritis. Rheumatology (Oxford) 2004;43:960-4.
- Okamoto Y, Gotoh Y, Tokui H, Mizuno A, Kobayashi Y, Nishida M. Characterization of the cytokine network at a single cell level in mice with collagen-induced arthritis using a dual color ELISPOT assay. J Interferon Cytokine Res 2000;20:55-61.
- Schloot NC, Meierhoff G, Karlsson FM, Ott P, Putnam A, Lehmann P, Gottlieb P, Roep BO, Peakman M, Tree T. Comparison of cytokine ELISpot assay formats for the detection of islet antigen autoreactive T cells. Report of the third immunology of diabetes society T-cell workshop. J Autoimmun 2003;21:365-76.
- Gabrielsson S, Paulie S, Roquet A, Ihre E, Lagging E, van Hage-Hamsten M, Harfast B, Troye Blomberg M. Increased allergen-specific Th2 responses in vitro in atopic subjects receiving subclinical allergen challenge. Allergy 1997;52:860-5.
- Gabrielsson S, Soderlund A, Paulie S, Rak S, van der Pouw Kraan TC, Troye Blomberg M. Increased frequencies of allergen-induced interleukin-13-producing cells in atopic individuals during the pollen season. Scand J Immunol 1998;48:429-35.
- Thomas P, Pfutzner W, Przybilla B. Frequency and activity of IgE-secreting peripheral blood B-cells in atopic eczema. Acta Derm Venereol 1995;75:422-5.
- Hauer AC, Riederer M, Griessl A, Rosegger H, MacDonald TT. Cytokine production by cord blood mononuclear cells stimulated with cows milk proteins in vitro: interleukin-4 and transforming growth factor beta-secreting cells detected in the CD45RO T cell population in children of atopic mothers. Clin Exp Allergy 2003;33:615-23.
- Hauer AC, Breese EJ, Walker-Smith JA, MacDonald TT. The frequency of cells secreting interferon-gamma and interleukin-4, -5, and -10 in the blood and duodenal mucosa of children with cow's milk hypersensitivity. Pediatr Res 1997;42:629-38.
- Straff W, Śpiewak R, Al Massaoudi T, Renn C, Merk H, Sachs B. Wasp venom-induced IL-5, IL-10 and IFN-gamma secretion from human PBMC from patients with wasp venom allergy is differentially inhibited by loratadine, desloratadine, fexofenadine and cimetidine. Allergy 2002;57(Suppl 73):155.
- Miyagawa T, Hamagami S, Ohhata I, Ochi T, Kishimoto S. Specific antibody-forming cells in bronchoalveolar lavage fluid of patients with summer-type hypersensitivity pneumonitis-detection by enzyme-linked immunospot (ELISPOT). Nihon Kyobu Shikkan Gakkai Zasshi 1993;31:840-7.
- Beeler A, Pichler WJ. In vitro tests of T cell-mediated drug hypersensitivity. Expert Rev Clin Immunol 2006;2:887-900.
- Śpiewak R. ELISpot a ELISA: Porównanie (Dokument elektroniczny). URL: http://www.elispot.pl/epl_el01.htm (stan: 29.11.2007)
- Sedgwick JD, Czerkinsky C. Detection of cell-surface molecules, secreted products of single cells and cellular proliferation by enzyme immunoassay. J Immunol Methods 1992;150:159-75.
- McCutcheon M, Wehner N, Wensky A, Kushner M, Doan S, Hsiao L, Calabresi P, Ha T, Tran TV, Tate KM. A sensitive ELISPOT assay to detect low-frequency human T lymphocytes. J Immunol Methods 1997;210:149-66.
- Ewen C, Baca-Estrada ME. Evaluation of interleukin-4 concentration by ELISA is influenced by the consumption of IL-4 by cultured cells. J Interferon Cytokine Res 2001;21:39-43.
- Masjedi K, Ahlborg N, Gruvberger B, Bruze M, Karlberg AT. Methylisothiazolinones elicit increased production of both T helper (Th)1- and Th2-like cytokines by peripheral blood mononuclear cells from contact allergic individuals. Br J Dermatol 2003;149:1172-82.
- Minang JT, Ahlborg N, Troye-Blomberg M. A simplified ELISpot assay protocol used for detection of human interleukin-4, interleukin-13 and interferon-gamma production in response to the contact allergen nickel. Exogenous Dermatology 2003;2:306-13.
- Minang JT, Arestrom I, Zuber B, Jonsson G, Troye-Blomberg M, Ahlborg N. Nickel-induced IL-10 down-regulates Th1- but not Th2-type cytokine responses to the contact allergen nickel. Clin Exp Immunol 2006;143:494-502.
- Minang JT, Troye-Blomberg M, Lundeberg L, Ahlborg N. Nickel elicits concomitant and correlated in vitro production of Th1-, Th2-type and regulatory cytokines in subjects with contact allergy to nickel. Scand J Immunol 2005;62:289-96.
- Minang JT, Arestrom I, Troye-Blomberg M, Lundeberg L, Ahlborg N. Nickel, cobalt, chromium, palladium and gold induce a mixed Th1- and Th2-type cytokine response in vitro in subjects with contact allergy to the respective metals. Clin Exp Immunol 2006;146:417-26.
- Śpiewak R, Moed H, von Blomberg BME, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. Allergic contact dermatitis to nickel: modified in vitro test protocols for better detection of allergen-specific response. Contact Dermatitis 2007;56:63-9.
- Śpiewak R, Moed H, von Blomberg BME, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. Diagnosis in vitro of contact allergy to nickel: Th2-skewing of PBMC cultures improves the detection of allergen-specific lymphocyte response. Allergy Clin Immunol Int: J World Allergy Org 2005; 17:20-1.
- Śpiewak R, Moed H, von Blomberg BME, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. ELISPOT: potentielle in vitro test voor contactallergie - protocolontwikkeling en eerste resultaten. Ned Tijdschr Dermatol Venereol 2004;14:61.
- Śpiewak R, Moed H, von Blomberg BME, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. ELISPOT: Th2-polarisatie verbetert in vitro detectie van allergeenspecifieke T-celrespons in contact allergie tegen nikkel. Ned Tijdschr Dermatol Venereol 2005;15:64.
- Webb EF, Tzimas MN, Newsholme SJ, Griswold DE. Intralesional cytokines in chronic oxazolone-induced contact sensitivity suggest roles for tumor necrosis factor alpha and interleukin-4. J Invest Dermatol 1998;111:86-92.
- Xu H, DiIulio NA, Fairchild RL. T cell populations primed by hapten sensitization in contact sensitivity are distinguished by polarized patterns of cytokine production: interferon gamma-producing (Tc1) effector CD8+ T cells and interleukin (IL) 4/IL-10-producing (Th2) negative regulatory CD4+ T cells. J Exp Med 1996;183:1001-12.
- Jakobson E, Masjedi K, Ahlborg N, Lundeberg L, Karlberg AT, Scheynius A. Cytokine production in nickel-sensitized individuals analysed with enzyme-linked immunospot assay: possible implication for diagnosis. Br J Dermatol 2002;147:442-9.
- Lindemann M, Bohmer J, Zabel M, Grosse-Wilde H. ELISpot: a new tool for the detection of nickel sensitization. Clin Exp Allergy 2003;33:992-8.
- Śpiewak R, Moed H, von Blomberg BME, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. In vitro diagnosis of contact allergy to nickel: The value of the ELISpot assay. J Invest Dermatol 2005;125(3 Suppl): A52.
- Śpiewak R, Moed H, von Blomberg BME, Bruynzeel DP, Scheper RJ, Gibbs S, Rustemeyer T. In vitro diagnosis of nickel allergy. Contact Dermatitis 2006;55(Suppl 1):25-6.
- Śpiewak R, Czarnobilska E, Jenner B, Curzytek K, Piętowska J, Obtułowicz K. Contact allergy to nickel: Perspectives for reliable laboratory diagnosis. Allergy 2007;62(Suppl 83):435.
© Radosław Śpiewak
